ケトン食は骨髄由来抑制細胞の働きを抑制する
がん細胞ではワールブルグ効果によって解糖系が亢進しているため、乳酸や水素イオンの産生が増えて、がん組織自体が酸性化しています。 がん組織の酸性化が免疫担当細胞の働きを弱め、骨髄由来抑制細胞を増やすことが報告されています。 したがって、がん細胞のグルコース取り込みや解糖系を阻害するケトン食は骨髄由来抑制細胞の動員や増殖を抑制することになるので、がん組織内で抑制されている抗腫瘍免疫を改善する効果が期待できます。
■
【体内には免疫細胞の働きを抑制する細胞が存在する】
私たちの体内では、リンパ球(T細胞・B細胞・ナチュラルキラー細胞など)やマクロファージや樹状細胞といった免疫細胞が、病原微生物(ウイルス、細菌、真菌など)やがん細胞を排除するために働いています。
したがって、免疫力が低下すると、がんや感染症が発生しやすくなります。
免疫力が低下する原因としては加齢(老化)や過労やストレスなどがあります。
抗がん剤治療や放射線治療も免疫力を低下させる原因となり、がん治療中あるいは治療後の免疫力の低下は再発を促進し、生存期間を短くする重要なリスク要因となっています。
免疫力が低下すると感染症やがんの発生を許してしまいますが、免疫力が高すぎると自分の細胞を攻撃して自己免疫疾患の病気を引き起こすリスクもあります。
そこで、免疫細胞が自分の体を過剰に攻撃してしまうことを防ぐ目的で、健常な人の免疫系には免疫細胞の働きを抑制する細胞が存在します。
つまり体内の免疫システムは、病原菌やがん細胞を排除するために免疫細胞の働きを高める仕組みと、免疫細胞が過剰に働かないように抑制する仕組みがバランスをとって制御されているのです。
免疫細胞の働きを抑制する細胞の一つが骨髄由来抑制細胞(Myeloid-derived suppressor cells: MDSCs)です。この細胞は顆粒球のマーカーと単球/マクロファージのマーカーとを同時に発現している未熟な段階の骨髄由来細胞で、免疫反応を強力に抑制する働きを持っています。
骨髄由来抑制細胞はアルギナーゼや活性酸素、一酸化窒素、IL-10、TGF-βなどの産生を介して免疫担当細胞の活性を阻害したり、制御性T細胞(Treg)の誘導をきたすことによって免疫抑制作用を発揮します。(Tregは免疫応答を抑制性に制御するT細胞の一種)
【がん組織には骨髄由来抑制細胞が増えている】
正常な場合には、免疫系が過剰に働いて自らの体を攻撃してしまう自己免疫疾患にならないように、骨髄由来抑制細胞がブレーキをかけています。つまりこの細胞は、健康な人にとっては、むしろ良い働きを担っています。
一方、炎症時や担がん(体内にがんがある)状態では、骨髄由来抑制細胞が病巣部位のみならず循環血中やリンパ組織(リンパ節や脾臓など)においても増加することが報告されています。
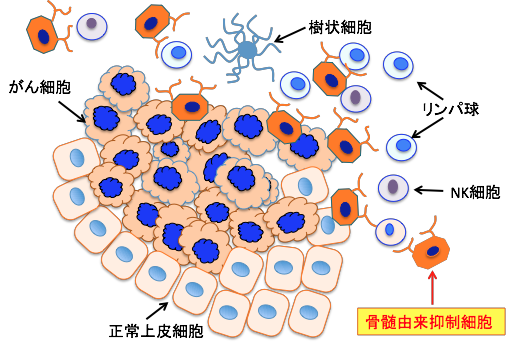
がん細胞は免疫抑制性の骨髄由来抑制細胞をがん組織内に動員させることによって、キラーT細胞やNK細胞からの攻撃を抑えていることが明らかになっています。つまり、がん細胞を攻撃・排除しようとするナチュラルキラー細胞(NK細胞)や細胞傷害性T細胞(キラーT細胞)の働きが、がん組織内では骨髄由来抑制細胞の増加によって抑制されているのです。
がん組織内でこのような免疫抑制細胞が増殖しているため、免疫細胞による攻撃や排除が起こりにくくなっていることが明らかになっています。
がん細胞を攻撃する免疫細胞の働きを良くするためには骨髄由来抑制細胞の活性を弱めることが重要だと考えられています。
| 図:がん組織では、様々なメカニズムによって骨髄由来抑制細胞が増えている。この細胞はがん細胞を攻撃・排除するキラーT細胞やナチュラルキラー細胞(NK細胞)や樹状細胞の働きを阻害している。その結果、がん細胞を排除する免疫応答が十分に行われなくなっている。 |
【がん組織の酸性化を是正すると抗腫瘍免疫は高まる】
担がん状態(体内にがんがある状態)では、がん組織のみならず、循環血液中や免疫組織でも骨髄由来抑制細胞が増えており、これががん患者さんの免疫力が低下する大きな理由になっています。
したがって、このような免疫抑制細胞が骨髄から動員されるメカニズムを理解し、免疫抑制状態を解除することががん治療の効果を高める上で重要な戦略になります。
実際に骨髄由来抑制細胞の働きを抑える抗体薬などが開発されています。また、シクロホスファミドなどの抗がん剤を低用量使用することによって、制御性T細胞や骨髄由来免疫抑制細胞のような免疫抑制細胞を減らす研究も進んでいます。
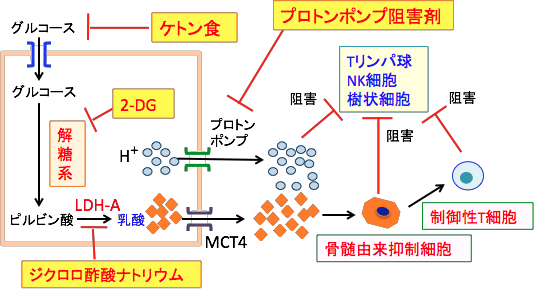
がん細胞ではグルコースの取込みと解糖系が亢進し、乳酸と水素イオンの産生が高まっています。乳酸はモノカルボン酸トランスポーター4(MCT4)を通って細胞外に排出され、水素イオンはプロトンポンプで細胞外に排出されます。
その結果、がん細胞周辺ではpHが低下(酸性化)します。
組織の酸性化は多くの免疫担当細胞の働きを阻害します。しかし、組織の酸性化は骨髄由来抑制細胞の増殖や働きを促進することが報告されています。 以下のような論文があります。
Tumor-derived lactate and myeloid-derived suppressor cells: Linking metabolism to cancer immunology.(腫瘍由来の乳酸と骨髄由来抑制細胞:代謝とがん免疫の関連)Oncoimmunology. 2013 Nov 1;2(11):e26383. Epub 2013 Oct 9.http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3881600/
【要旨】 多くのがん細胞は乳酸の産生が増えており、これが骨髄由来抑制細胞の増殖を促進している。 がん組織の微小環境における骨髄由来抑制細胞と乳酸と酸性化(pHの低下)はナチュラルキラー細胞やTリンパ球の働きを阻害し、がん細胞の増殖を許してしまう。ケトン食は担がん動物で増えている骨髄由来抑制細胞や制御性T細胞を排除して、免疫状態を改善する作用がある。
がん細胞ではワールブルグ効果によって解糖系が亢進しているため、乳酸や水素イオンの産生が増えて、がん組織自体が酸性化しています。がん組織の酸性化が免疫担当細胞の働きを弱め、骨髄由来抑制細胞を増やすことが報告されています。
したがって、がん細胞のグルコース取り込みや解糖系を阻害するケトン食は骨髄由来抑制細胞の動員や増殖を抑制することになるので、がん組織内で抑制されている抗腫瘍免疫を改善する効果が期待できるという趣旨です。
解糖系を阻害する方法としては2−デオキシグルコースやジクロロ酢酸ナトリウムも有効です。 水素イオン(プロトン)の排出を阻害する胃酸分泌阻害剤のプロトンポンプ阻害剤も利用できます。(下図)
| 図:がん細胞はグルコースと解糖系が亢進し、乳酸と水素イオン(プロトン)の産生が増えている。乳酸はモノカルボン酸トランスポーター4(MCT4)によって細胞外へ排出され、水素イオン(プロトン)はプロトンポンプで細胞外に排出される。細胞外に排出された乳酸と水素イオンはがん組織を酸性化し、Tリンパ球やNK細胞や樹状細胞などの免疫担当細胞の働きを阻害する。一方、乳酸やプロトン(H+)の産生増加によってpHが低下し酸性になると免疫細胞の働きを抑制する骨髄由来抑制細胞が動員され活性が亢進する。 |
【COX-2阻害剤のセレコキシブは抗腫瘍免疫の活性を高める】
シクロオキシゲナーゼ(Cyclooxygenase)はアラキドン酸からプロスタグランジンを合成する過程の律速酵素です。 細胞膜からホスホリパーゼA2でアラキドン酸が遊離し、ついでCOXによってプロスタグランジンH2が生成され、さらに別々の酵素によってプロスタグランジンD2, F2α, E2, I2, トロンボキサンA2が生成されます。
これらのプロスタグランジンやトロンボキサンは血管拡張、胃粘膜の保護作用、腎機能、血小板凝集など生理的なはたらきの他に、発熱、痛み、炎症など病的状態にも関与しています。
シクロオキシゲナーゼ(COX)には、正常な生理機能に必要なCOX-1と、炎症やがんで発現が誘導されるCOX-2の2種類のアイソフォームが知られています。
多くのがん細胞で、COX-2活性とミクロゾームのプロスタグランジンE合成酵素1(prostaglandin E synthase 1)の活性が恒常的に亢進し、プロスタグランジンE2の産生が亢進しています。
プロスタグランジンE2は細胞膜にあるEP受容体(EP1, EP2, EP3, and EP4)に結合して、細胞内シグナル伝達系を介して、がん細胞の増殖促進やアポトーシス抵抗性の効果を示します。プロスタグランジンE2はEGFRを活性化してがん細胞の増殖や生存を亢進する作用があります。さらに、プロスタグランジンE2はSTAT3の活性化によってサイクリンD1の転写を促進して細胞増殖を亢進し、STAT3はBcl-xLの転写を促進してアポトーシス抵抗性にします。
がん組織では、マクロファージなどの炎症細胞もCOX-2の活性が亢進しています。
プロスタグランジンE2はがん細胞の増殖や血管新生を促進する作用や、がん細胞を攻撃するTリンパ球やナチュラルキラー細胞(NK細胞)の働きを阻害する作用があります。 さらに、骨髄由来抑制細胞を動員して数を増やす作用もあります。 したがって、COX-2の選択的阻害剤のセレコキシブ(celecoxib)は抗腫瘍免疫を高める効果があります。(セレコキシブの商品名はセレコックス)
その他、活性酸素や一酸化窒素などのフリーラジカルも免疫担当細胞の働きを阻害するので、抗酸化物質は免疫増強に有効です。 胃酸分泌を抑制するヒスタミン受容体拮抗薬のシメチジンは骨髄由来抑制細胞のアポトーシスを誘導して抗腫瘍免疫を高めるという報告があります。
以上のことから、PGE2や活性酸素の産生やがん組織の酸性化や骨髄由来抑制細胞の動員を阻止すれば、がん細胞を攻撃・排除する免疫担当細胞の働きを高めることができると言えます。
COX-2の阻害剤であるセレコキシブ、がん細胞の解糖系を阻害する2-デオキシグルコース、ジクロロ酢酸ナトリウム、ケトン食、水素イオンの細胞外排出を阻害するプロトンポンプ阻害剤、活性酸素を消去する抗酸化剤、骨髄由来抑制細胞を阻害するシメチジンなどは、ペプチドワクチン療法や樹状細胞療法やリンパ球療法などの免疫療法に併用すると、それらの効果を高めることが予想されます。このような免疫療法を受ける時は、がん細胞周囲の骨髄由来抑制細胞の働きや数を低下させる方法を積極的に実施するのが良いと言えます。
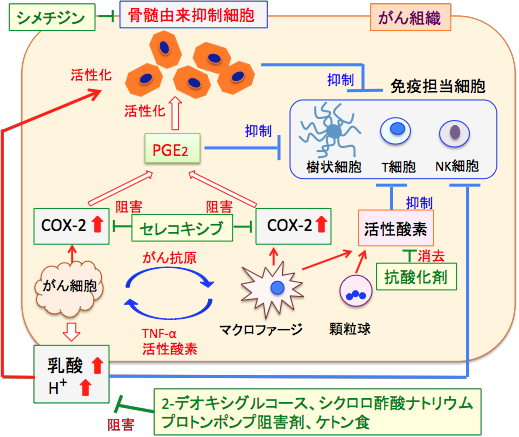 |
図:がん組織内ではマクロファージなどの炎症細胞やがん細胞の細胞内でシクロオキシゲナーゼ-2(COX-2)の発現と活性が亢進している。COX-2はプロスタグランジンE2(PGE2)の産生を増やし、炎症細胞からは活性酸素が産生される。PGE2と活性酸素は、免疫担当細胞(樹状細胞、リンパ球、NK細胞など)の働きを抑制する。一方、PGE2は骨髄由来抑制細胞を動員しがん組織内で増える。この骨髄由来抑制細胞は免疫担当細胞の働きを抑制する。乳酸や水素イオンによるがん組織の酸性化は、免疫担当細胞の働きを抑制するが、骨髄由来抑制細胞の働きは活性化する。したがって、PGE2や活性酸素の産生やがん組織の酸性化や骨髄由来抑制細胞の動員を阻止すれば、がん細胞を攻撃・排除する免疫担当細胞の働きを高めることができる。 |
|---|